更多对称“热点”实现更强的等离子体增强荧光:从金纳米棒到金纳米星
低丰度特异性生物标志物 (如miRNAs) 的高灵敏检测对于肿瘤等疾病的早期诊断、治疗和发病机制研究具有重要作用。传统的miRNAs检测方法如实时聚合酶链式反应、Northern杂交、微阵列分析和电化学分析等,无法实现活细胞中低丰度miRNA的原位直接监测,荧光传感成像技术因其能实现活细胞中miRNAs的原位实时监测而引起了广泛的关注。然而,传统的荧光染料探针在成像检测中存在两个明显缺点:(1)易光漂白且光稳定性差;(2)单细胞水平靶标物浓度较低导致荧光信号较弱。
针对上述问题,必威BETWAY官网徐升豪副教授和罗细亮教授课题组在前期纳米探针合成和等离子体增强荧光的研究工作基础上(Anal. Chem. 2020, 92, 15169-15178; Anal. Chem. 2019, 91, 13947-13952; Anal. Chem. 2018, 90, 4039-4045; Anal. Chem. 2014, 86, 11634-11639; Chem. Commun., 2020, 56, 13828-13831; Chem. Commun. 2020, 56, 4074-4077; ACS Appl. Mater. Interfaces 2018, 10, 26851-26858; ACS Appl. Mater. Interfaces 2020, 12, 373-379),首次以含有20个对称尖端热点的金纳米星作为等离子体激元共振基底材料(图1所示),构建了一种简单而有效的新型等离子体增强荧光纳米探针,实现了活细胞内miRNA-21的高灵敏“点亮式”原位成像检测。BHQ-3标记的辅助DNA1与Cy5.5标记的辅助DNA2部分互补杂交而形成荧光猝灭的辅助探针,随后将辅助探针键合到包覆二氧化硅的金纳米型表面得到离子体增强荧光纳米探针,探针进入细胞后,靶标物miRNA-21与Cy5.5标记的辅助DNA2完全杂交而将BHQ-3标记的辅助DNA1替换导致染料的红色荧光恢复。通过调节二氧化硅壳层的厚度来调控染料与金纳米星之间的距离,最终得到了最佳的等离子体增强荧光效果,实现了活细胞内miRNA-21的高灵敏原位成像检测(图2所示)。

图1金纳米星的透射电镜和扫描电镜图像。图片来源:Anal. Chem.
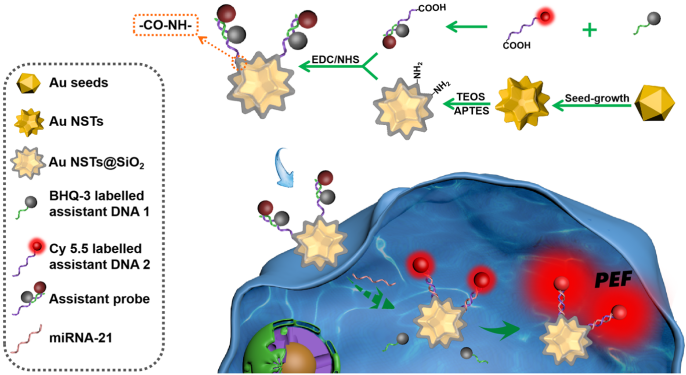
图2 基于金纳米星的新型等离子体增强荧光纳米探针用于细胞内miRNA-21的高灵敏原位成像检测示意图。图片来源:Anal. Chem.
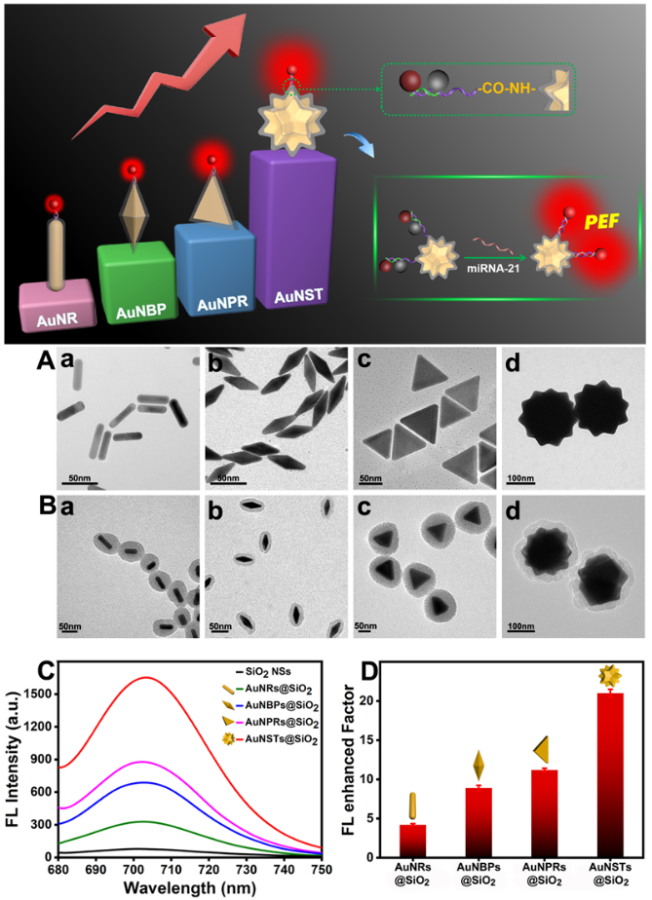
相比于传统的等离子体增强荧光基底材料(金纳米棒、金纳米双锥体和金纳米三角片等),含有20个对称尖端的金纳米星具有更多的局域等离子体电场热点“hot spots”而显示了更优的等离子体增强荧光效果(图3所示)。该工作为新型等离子体增强荧光纳米探针的设计以及低丰度肿瘤标志物的高灵敏检测提供了新思路。
图3 基于金纳米棒、金纳米双锥体、金纳米三角片和金纳米星的等离子体增强荧光对比结果。图片来源:Anal. Chem.
该研究成果近期发表在Analytical Chemistry 上,文章的第一作者是2018级硕士研究生高宇环,通讯作者是徐升豪副教授和罗细亮教授。该研究得到国家自然科学基金(21675093、21505081、21974075)、山东省省属优青(ZR2019YQ13)、山东省高校优秀青年创新团队项目(2019KJC007)和山东省泰山学者建设专项基金(ts20110829)的资助支持。
论文信息:https://pubs.acs.org/doi/10.1021/acs.analchem.0c04518
Yuhuan Gao, Jun Wang, Weina Wang, Tingting Zhao, Yanyun Cui, Pingping Liu, Shenghao Xu,* and Xiliang Luo*, More Symmetrical “Hot Spots” Ensure Stronger Plasmon-Enhanced Fluorescence: From Au Nanorods to Nanostars, Anal. Chem., 2021, 93, 2480-2489.